A koleszterinhipotézis II - a zsírszegény étrend története
Az ezt megelőző írásomban történeti szempontból mutattam be, hogy hogyan alakult ki a jelenleg domináló, de egyre egyértelműbben problémás alacsony zsírbevitelre, helyette inkább a szénhidrátokra alapuló táplálkozási ajánlásrendszer. Bár az ajánlások megkérdőjelezhető tudományossággal, egyéni elfogultságoknak köszönhetően lett sikeres, nagy elvárásokat támasztottak felé, a koleszterinszint csökkentésén keresztül a hosszú élet titkának tartották sokáig. Az utóbbi két tényező összefüggését bizonyítani sohasem sikerült, az emelkedő szénhidrátfogyasztás pedig komoly károkat tett az emberek egészségében. A folytatásban azt a kérdést járom körbe, hogy a koleszterinhipotézis biológiailag miért lehet megalapozatlan.
Inzulin
Az előzőekben többször feljött a cukor, az inzulin, az inzulinrezisztencia és a diabétesz. Ezek a tényezők nagyobb szerepet játszanak a zsíranyagcserében, mint maguk a bevitt zsírok. A tápanyag hasznosításának karmestere az inzulin hormon, amely akkor választódik el a hasnyálmirigyben, ha emelkedik a vércukor, és ez csakis cukrok és összetett szénhidrátok fogyasztásakor történik meg. Az inzulin szerepéről, működéséről és kóros működéséről Az inzulinrezisztencia életmódbeli okai cikkemben elég részletesen írok, itt a zsíranyagcserében betöltött működését mutatom be. Az inzulin feladata általánosságban a felvett táplálék bejuttatása a sejtekbe és raktározása, a felépítő folyamatok támogatása, ezt számos enzim szabályozásával éri el. Például aktiválja a koleszterinszintézis már említett kulcsenzimét és emeli a vér koleszterinszintjét. De emeli a vérzsírszintet és fokozza a zsírraktározást is: mind a zsírsavak, mind az azokból álló, raktározható trigliceridek szintézisét is az inzulin indítja be, enzimszabályozáson1 keresztül. A zsírokat alkotó atomok jellemzően cukorból származnak, de ha a táplálék elsősorban zsírból áll, akkor is inzulin szükséges a raktározáshoz – minél több inzulin, annál több zsírszintézis és raktározás, és minél több cukor, annál több inzulin. Ezért is hívja fel a Royal Pharmaceutical Society írása a figyelmet az inzulinrezisztencia és a szénhidrátok veszélyeire. A fokozott triglicerid (zsír)- szintézis emelkedett vér triglicerid-szintet eredményez, amit ma a koleszterinnél valósabb rizikófaktorként tartanak számon a szakértők. Ennek az oka lehet, hogy a magasabb vér triglicerid szint a nemsokára említett és részletezett kis, sűrű sdLDL részecskék koncentrációját növeli a vérben.
Hol kezdődik az érelmeszesedés?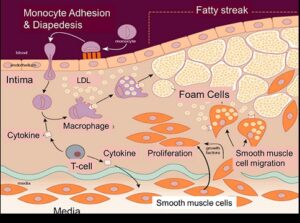 De tulajdonképpen milyen szerepet játszanak a lipidek, a koleszterin, a szív-és érrendszeri megbetegedésekben?
Az érelmeszesedés, idegen szóval atherosclerosis kialakulásában van kulcsszerepük. Az érelmeszesedés az artériák falának kóros elváltozása, megkeményedése és megvastadodása. Ekkor az artériák fala merevebbé válik, ami törékenyebbé teszi őket, az ér belső terének, lumenének beszűkülése pedig az elzáródás (pl. embólia esetén) kockázatát emeli.
Az érelmeszesedés mechanizmusa nagyjából ismert, a kiváltó okról viszont nincs egyértelmű tudományos egyetértés.
Az LDL funkciója, mint azt már korábban írtam, koleszterin és egyéb lipidek szállítása a keletkezés helyéről, azaz a májból a felhasználás helyére. Normál esetben az LDL részecskék szabályozott módon, az érfal hámsejtjein keresztül (ún. transzcitózissal) jutnak ki az érből. A koleszterin felhasználódik a környező sejtek által, a felesleges mennyiséget pedig a helyben létrejövő HDL juttatja vissza a májba, ami képes eltávolítani azt az epével.
Ha viszont az érfal integritása sérül, és/vagy2 túl sok LDL van a vérben, akkor a lipoproteinek a hámsejtek között átférkőzve, korlátlan mennyiségben tudnak az érfalba jutni. Itt a hámsejtek által kibocsátott anyagok hatására oxidálódnak, és az oxidált LDL-t a vérből kilépő falósejtek, makrofágok kebelezik be. A sok LDL-t felvett makrofágokat ‘habos sejteknek’ nevezzük, ezek elhalva adják a plakk fő tömegét, amely kalcium berakódásával az évek során szilárdul, meszesedik és nő, csökkentve az ér átmérőjét.
A nagy kérdés, hogy molekuláris szinten mi indítja el a plakk-képződést, nem tisztázott. Két fő hipotézis ismert: a ‘response-to-retention’ és a ‘response-to-injury’, azaz vagy az LDL-felvételre, vagy az érfal sérülésére adott válasz lehet a folyamat kiváltó oka. Az első feltételezés szerint a vérben túl nagy mennyiségben keringő LDL különösebb nehézség nélkül bejut az érfalba, és a felhalmozódása indítja el az érelmeszesedést: A második álláspont úgy érvel, hogy az LDL azért kerül az adott területen az ér hámja alá, mert azt sérülés érte. Ezek szerint az ép hám nem engedné át az LDL-részecskéket, a plakk-képződés megindulásához a hámsejtek degradációja szükséges olyan tényezők által, mint például az érfalat feszülésre ingerlő dohányzás vagy magas vérnyomás, a sejteket támadó autoimmun folyamat, az erek falát köztudottan károsító magas vércukor vagy egyéb potenciálisan káros hatás. Tehát az LDL és az immunsejtek felszabadulása egy sérülésre adott válaszreakció, akár védekezési, reparációs mechanizmus lehet. A következő szakkönyv-fejezetben3 az írók a sejtek közötti tér, az extracelluláris mátrix anyagainak nagymértékű és szokatlan struktúrájú felszaporodásáról számolnak be az érfalban az érelmeszesedés nagyon korai fázisában, amely károsító anyagok jelenlétének tudható be. Ez a megváltozott extracelluláris mátrix, a normálistól eltérően, LDL-részecskéket vonz. Ugyanakkor ez, a ‘response-to-retention’ hipotézist hirdető cikk4 megállapítja, hogy az érelmeszesedés kialakulásához mindenképp magas LDL szint kell.
Ha a feltételezett mechanizmusokat összevetjük a korábban idézett tanulmányok eredményeivel, melyek szerint az LDL-szint nem korrelál egyértelműen a szívbetegség kockázatával, viszont a gyulladáscsökkentő omega 3 és 9 zsírsavakat tartalmazó mediterrán étrend csökkenti a halálozási statisztikákat, annak ellenére, hogy a koleszterinszintet nem: gyanítható, hogy az LDL-felvételhez és az atheroszklerotikus plakk kialakulásához fontos a sérülés és gyulladás, ami a ‘szívvédő’, gyulladáscsökkentő omega-zsírsavak fogyasztásával megelőzhető. Tény tehát, hogy az LDL kulcsszerepet játszik az érelmeszesedés mechanizmusában, de nem valószínű, hogy önmagában oka lehet annak. Pontos ismeretek híján az LDL-re fogni a szívbetegséget kicsit olyan, mintha az immunrendszerünket hibáztatnánk, hogy a kórokozók elleni harcban fájdalmas gyulladást generál egy gennyes sebben, vagy a sebészt, hogy a helytelen életmód okán fejlődött rák kiemelése során megvágja a beteget.
De tulajdonképpen milyen szerepet játszanak a lipidek, a koleszterin, a szív-és érrendszeri megbetegedésekben?
Az érelmeszesedés, idegen szóval atherosclerosis kialakulásában van kulcsszerepük. Az érelmeszesedés az artériák falának kóros elváltozása, megkeményedése és megvastadodása. Ekkor az artériák fala merevebbé válik, ami törékenyebbé teszi őket, az ér belső terének, lumenének beszűkülése pedig az elzáródás (pl. embólia esetén) kockázatát emeli.
Az érelmeszesedés mechanizmusa nagyjából ismert, a kiváltó okról viszont nincs egyértelmű tudományos egyetértés.
Az LDL funkciója, mint azt már korábban írtam, koleszterin és egyéb lipidek szállítása a keletkezés helyéről, azaz a májból a felhasználás helyére. Normál esetben az LDL részecskék szabályozott módon, az érfal hámsejtjein keresztül (ún. transzcitózissal) jutnak ki az érből. A koleszterin felhasználódik a környező sejtek által, a felesleges mennyiséget pedig a helyben létrejövő HDL juttatja vissza a májba, ami képes eltávolítani azt az epével.
Ha viszont az érfal integritása sérül, és/vagy2 túl sok LDL van a vérben, akkor a lipoproteinek a hámsejtek között átférkőzve, korlátlan mennyiségben tudnak az érfalba jutni. Itt a hámsejtek által kibocsátott anyagok hatására oxidálódnak, és az oxidált LDL-t a vérből kilépő falósejtek, makrofágok kebelezik be. A sok LDL-t felvett makrofágokat ‘habos sejteknek’ nevezzük, ezek elhalva adják a plakk fő tömegét, amely kalcium berakódásával az évek során szilárdul, meszesedik és nő, csökkentve az ér átmérőjét.
A nagy kérdés, hogy molekuláris szinten mi indítja el a plakk-képződést, nem tisztázott. Két fő hipotézis ismert: a ‘response-to-retention’ és a ‘response-to-injury’, azaz vagy az LDL-felvételre, vagy az érfal sérülésére adott válasz lehet a folyamat kiváltó oka. Az első feltételezés szerint a vérben túl nagy mennyiségben keringő LDL különösebb nehézség nélkül bejut az érfalba, és a felhalmozódása indítja el az érelmeszesedést: A második álláspont úgy érvel, hogy az LDL azért kerül az adott területen az ér hámja alá, mert azt sérülés érte. Ezek szerint az ép hám nem engedné át az LDL-részecskéket, a plakk-képződés megindulásához a hámsejtek degradációja szükséges olyan tényezők által, mint például az érfalat feszülésre ingerlő dohányzás vagy magas vérnyomás, a sejteket támadó autoimmun folyamat, az erek falát köztudottan károsító magas vércukor vagy egyéb potenciálisan káros hatás. Tehát az LDL és az immunsejtek felszabadulása egy sérülésre adott válaszreakció, akár védekezési, reparációs mechanizmus lehet. A következő szakkönyv-fejezetben3 az írók a sejtek közötti tér, az extracelluláris mátrix anyagainak nagymértékű és szokatlan struktúrájú felszaporodásáról számolnak be az érfalban az érelmeszesedés nagyon korai fázisában, amely károsító anyagok jelenlétének tudható be. Ez a megváltozott extracelluláris mátrix, a normálistól eltérően, LDL-részecskéket vonz. Ugyanakkor ez, a ‘response-to-retention’ hipotézist hirdető cikk4 megállapítja, hogy az érelmeszesedés kialakulásához mindenképp magas LDL szint kell.
Ha a feltételezett mechanizmusokat összevetjük a korábban idézett tanulmányok eredményeivel, melyek szerint az LDL-szint nem korrelál egyértelműen a szívbetegség kockázatával, viszont a gyulladáscsökkentő omega 3 és 9 zsírsavakat tartalmazó mediterrán étrend csökkenti a halálozási statisztikákat, annak ellenére, hogy a koleszterinszintet nem: gyanítható, hogy az LDL-felvételhez és az atheroszklerotikus plakk kialakulásához fontos a sérülés és gyulladás, ami a ‘szívvédő’, gyulladáscsökkentő omega-zsírsavak fogyasztásával megelőzhető. Tény tehát, hogy az LDL kulcsszerepet játszik az érelmeszesedés mechanizmusában, de nem valószínű, hogy önmagában oka lehet annak. Pontos ismeretek híján az LDL-re fogni a szívbetegséget kicsit olyan, mintha az immunrendszerünket hibáztatnánk, hogy a kórokozók elleni harcban fájdalmas gyulladást generál egy gennyes sebben, vagy a sebészt, hogy a helytelen életmód okán fejlődött rák kiemelése során megvágja a beteget.
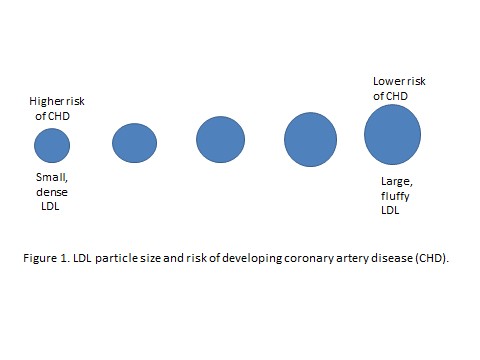 Ráadásul az LDL-nek vannak altípusai. Ilyen a ‘small dense’ (kicsi, nehéz) és a ‘large bouyant’ (nagyobb, könnyebb) LDL. Ezek megkülönböztetése, bár a vizsgálatokban még annyira nem elterjedt, nagyon fontos. Fontos, mert a kis méretű, small dense LDL, továbbiakban sdLD, sokkal fontosabb szerepet játszik az érelmeszesedésben, mint társai. Mivel kisebb és a sűrűsége nagyobb, könnyebben lép ki az érfalon, ha az nem zár megfelelően. Az étrend befolyásolja a keringő LDL részecskék méretét: a telített zsírok fogyasztása, úgy tűnik, hogy a kevésbé problémás nagy LDL-részecskék koncentrációját növeli5, viszont a nagy mennyiségű szénhidrát és a margarinok fogyasztása a kis sdLDL partikulumokét6 – a hivatkozott cikk szerint a vér trigliceridszintjének emelésén keresztül. A vér trigliceridszintje leginkább inzulin által növekszik, ez egy újabb jele annak, hogy a jelenleg érvényben lévő étrendi ajánlások nem töltik be megfelelően a rájuk ruházott szívvédő szerepet.
Membránok
A zsírszegény, főleg a telített zsírokban szegény diéta ajánlása szakmai körökben nem mindenhol váltott ki lelkesedést, sokakban inkább komoly aggodalmat. Minden sejtünket zsírmolekulákból álló membrán határolja és egyben köti össze a környezetével. A membránokban rengeteg ioncsatorna, recpetor található, és bekebelezési folyamatok mellett vegyületek szintézise és leadása is membránokhoz kötött. Az agy 70%-ban a neuronokat szigetelő zsírból áll. Az állati szervezet elsősorban telített zsírsavakat használ, az étrendi ajánlások viszont ezeket koleszterinnövelőnek bélyegezve a telítetlen zsírsavak fogyasztását javasolják. Olyan kutatók, mint a lipidszakértő E. H. Ahrens, aggodalmukat fejezték ki abban, hogy a telített zsírsavak és koleszterin bevitelének csökkentése megváltoztathatja a sejtmembránok struktúráját, áthatolhatóságát, integritását és a membránokhoz kapcsolt folyamatok működését. A koleszterin mindkét irányba képes befolyásolni a membránok folyékonyságát, így optimizálja azt. A telített zsírsavak inkább szilárdítják a membránt. A telítetlen zsírsavakban kettős kötés található, amely mentén töréspont alakul ki, a zsírsav elhajlik. Ezáltal több helyet foglal a térben, így lazítja és folyékonyabbá teszi a sejtmembránt. Ráadásul a kettős kötés könnyen roncsolódik, oxidálódik, ezért a telítetlen zsírsavak jobban ki vannak téve a káros hatásoknak. Bár a sejtek képesek a membránalkotó zsírsavak előállítására, ez sok energia, így a táplálékkal felvett zsírok felhasználása mindenképpen előnyös. Elképzelhető, hogy az elfogyasztott zsírok minőségi változása tükröződik a szervezet membránjain, ennek messzemenő következményei lehetnek.
Ráadásul az LDL-nek vannak altípusai. Ilyen a ‘small dense’ (kicsi, nehéz) és a ‘large bouyant’ (nagyobb, könnyebb) LDL. Ezek megkülönböztetése, bár a vizsgálatokban még annyira nem elterjedt, nagyon fontos. Fontos, mert a kis méretű, small dense LDL, továbbiakban sdLD, sokkal fontosabb szerepet játszik az érelmeszesedésben, mint társai. Mivel kisebb és a sűrűsége nagyobb, könnyebben lép ki az érfalon, ha az nem zár megfelelően. Az étrend befolyásolja a keringő LDL részecskék méretét: a telített zsírok fogyasztása, úgy tűnik, hogy a kevésbé problémás nagy LDL-részecskék koncentrációját növeli5, viszont a nagy mennyiségű szénhidrát és a margarinok fogyasztása a kis sdLDL partikulumokét6 – a hivatkozott cikk szerint a vér trigliceridszintjének emelésén keresztül. A vér trigliceridszintje leginkább inzulin által növekszik, ez egy újabb jele annak, hogy a jelenleg érvényben lévő étrendi ajánlások nem töltik be megfelelően a rájuk ruházott szívvédő szerepet.
Membránok
A zsírszegény, főleg a telített zsírokban szegény diéta ajánlása szakmai körökben nem mindenhol váltott ki lelkesedést, sokakban inkább komoly aggodalmat. Minden sejtünket zsírmolekulákból álló membrán határolja és egyben köti össze a környezetével. A membránokban rengeteg ioncsatorna, recpetor található, és bekebelezési folyamatok mellett vegyületek szintézise és leadása is membránokhoz kötött. Az agy 70%-ban a neuronokat szigetelő zsírból áll. Az állati szervezet elsősorban telített zsírsavakat használ, az étrendi ajánlások viszont ezeket koleszterinnövelőnek bélyegezve a telítetlen zsírsavak fogyasztását javasolják. Olyan kutatók, mint a lipidszakértő E. H. Ahrens, aggodalmukat fejezték ki abban, hogy a telített zsírsavak és koleszterin bevitelének csökkentése megváltoztathatja a sejtmembránok struktúráját, áthatolhatóságát, integritását és a membránokhoz kapcsolt folyamatok működését. A koleszterin mindkét irányba képes befolyásolni a membránok folyékonyságát, így optimizálja azt. A telített zsírsavak inkább szilárdítják a membránt. A telítetlen zsírsavakban kettős kötés található, amely mentén töréspont alakul ki, a zsírsav elhajlik. Ezáltal több helyet foglal a térben, így lazítja és folyékonyabbá teszi a sejtmembránt. Ráadásul a kettős kötés könnyen roncsolódik, oxidálódik, ezért a telítetlen zsírsavak jobban ki vannak téve a káros hatásoknak. Bár a sejtek képesek a membránalkotó zsírsavak előállítására, ez sok energia, így a táplálékkal felvett zsírok felhasználása mindenképpen előnyös. Elképzelhető, hogy az elfogyasztott zsírok minőségi változása tükröződik a szervezet membránjain, ennek messzemenő következményei lehetnek.
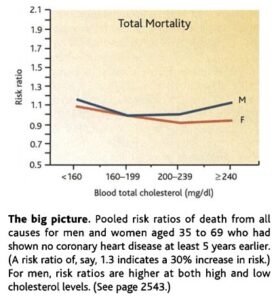 A végére ez az ábra lehet érdekes Gary Taubes cikkéből, amely pusztán összefüggéseket mutat. Ez alapján nőknél csak az alacsony, férfiaknál mind a túl alacsony, mind a túl magas koleszterin kockázati tényező. Az ábrából az általános életmódtényezők nem megismerhetők, de a koleszterincsökkentés túlzásba vitele nem tűnik jó ötletnek az adatai alapján.
Ez a cikk tulajdonképpen csak a felszínt kapargatja, az emberi test működése önmagában is elképesztően bonyolult, hát még, ha belevesszük az egyenletbe a különböző táplálkozási protokollokat. A megfelelő táplálkozással kapcsolatban ökölszabály, hogy érdemes az ételeket a lehető legtermészetesebb formában bevinni. A három és fél százalékos zsírtartalmú, tejen kívül csak baktériumokat tartalmazó görög joghurt biztosan jobb, mint a másfél, fél, vagy 0,1 százalékos, cukrozott, ízfokozót tartalmazó low fat termék, és a jó tartásból származó szalonna is jobb opció a védőgázból frissen kicsomagolt light sonkánál. Összességében viszont a természetesség nem elegendő válasz, ha az ember olyan intő tüneteket tapasztal, mint a hullámzó energiaszint a nap során, a sok álmosság, a kajakóma vagy az evés után néhány órával bekövetkező ‘crash’. A szervezet rengeteg különböző hormonnal és szöveti faktorral, idegi mechanizmussal és emésztőenzimmel végzi a táplálék feldolgozását, felvételét, raktározását és szortírozását. A nagyszámú mechanizmus elképesztően bonyolult rendszere mozgásteret ad az egyéni különbségeknek és eltérő igényeknek; a test pedig azzal az üzemanyaggal működik legjobban, amely feldolgozásához megfelel a genetikája. Van, aki igényli a szénhidrátot, van, aki magas zsír-, de alacsony szénhidráttartalmú étrend mellett a legkiegyensúlyozottabb. Az egyéni anyagcseretípus megismerhető sok kísérletezéssel, és az Akadémia szolgáltatásai között szereplő Táplálkozási Profil kérdőívének szakemberrel történő kielemzése is segítséget – és sok jó tanácsot – nyújthat. A zsírok családjának többi tagjáról pedig hamarosan további cikkeket olvashattok tőlem a blogon.
A végére ez az ábra lehet érdekes Gary Taubes cikkéből, amely pusztán összefüggéseket mutat. Ez alapján nőknél csak az alacsony, férfiaknál mind a túl alacsony, mind a túl magas koleszterin kockázati tényező. Az ábrából az általános életmódtényezők nem megismerhetők, de a koleszterincsökkentés túlzásba vitele nem tűnik jó ötletnek az adatai alapján.
Ez a cikk tulajdonképpen csak a felszínt kapargatja, az emberi test működése önmagában is elképesztően bonyolult, hát még, ha belevesszük az egyenletbe a különböző táplálkozási protokollokat. A megfelelő táplálkozással kapcsolatban ökölszabály, hogy érdemes az ételeket a lehető legtermészetesebb formában bevinni. A három és fél százalékos zsírtartalmú, tejen kívül csak baktériumokat tartalmazó görög joghurt biztosan jobb, mint a másfél, fél, vagy 0,1 százalékos, cukrozott, ízfokozót tartalmazó low fat termék, és a jó tartásból származó szalonna is jobb opció a védőgázból frissen kicsomagolt light sonkánál. Összességében viszont a természetesség nem elegendő válasz, ha az ember olyan intő tüneteket tapasztal, mint a hullámzó energiaszint a nap során, a sok álmosság, a kajakóma vagy az evés után néhány órával bekövetkező ‘crash’. A szervezet rengeteg különböző hormonnal és szöveti faktorral, idegi mechanizmussal és emésztőenzimmel végzi a táplálék feldolgozását, felvételét, raktározását és szortírozását. A nagyszámú mechanizmus elképesztően bonyolult rendszere mozgásteret ad az egyéni különbségeknek és eltérő igényeknek; a test pedig azzal az üzemanyaggal működik legjobban, amely feldolgozásához megfelel a genetikája. Van, aki igényli a szénhidrátot, van, aki magas zsír-, de alacsony szénhidráttartalmú étrend mellett a legkiegyensúlyozottabb. Az egyéni anyagcseretípus megismerhető sok kísérletezéssel, és az Akadémia szolgáltatásai között szereplő Táplálkozási Profil kérdőívének szakemberrel történő kielemzése is segítséget – és sok jó tanácsot – nyújthat. A zsírok családjának többi tagjáról pedig hamarosan további cikkeket olvashattok tőlem a blogon.
 De tulajdonképpen milyen szerepet játszanak a lipidek, a koleszterin, a szív-és érrendszeri megbetegedésekben?
Az érelmeszesedés, idegen szóval atherosclerosis kialakulásában van kulcsszerepük. Az érelmeszesedés az artériák falának kóros elváltozása, megkeményedése és megvastadodása. Ekkor az artériák fala merevebbé válik, ami törékenyebbé teszi őket, az ér belső terének, lumenének beszűkülése pedig az elzáródás (pl. embólia esetén) kockázatát emeli.
Az érelmeszesedés mechanizmusa nagyjából ismert, a kiváltó okról viszont nincs egyértelmű tudományos egyetértés.
Az LDL funkciója, mint azt már korábban írtam, koleszterin és egyéb lipidek szállítása a keletkezés helyéről, azaz a májból a felhasználás helyére. Normál esetben az LDL részecskék szabályozott módon, az érfal hámsejtjein keresztül (ún. transzcitózissal) jutnak ki az érből. A koleszterin felhasználódik a környező sejtek által, a felesleges mennyiséget pedig a helyben létrejövő HDL juttatja vissza a májba, ami képes eltávolítani azt az epével.
Ha viszont az érfal integritása sérül, és/vagy2 túl sok LDL van a vérben, akkor a lipoproteinek a hámsejtek között átférkőzve, korlátlan mennyiségben tudnak az érfalba jutni. Itt a hámsejtek által kibocsátott anyagok hatására oxidálódnak, és az oxidált LDL-t a vérből kilépő falósejtek, makrofágok kebelezik be. A sok LDL-t felvett makrofágokat ‘habos sejteknek’ nevezzük, ezek elhalva adják a plakk fő tömegét, amely kalcium berakódásával az évek során szilárdul, meszesedik és nő, csökkentve az ér átmérőjét.
A nagy kérdés, hogy molekuláris szinten mi indítja el a plakk-képződést, nem tisztázott. Két fő hipotézis ismert: a ‘response-to-retention’ és a ‘response-to-injury’, azaz vagy az LDL-felvételre, vagy az érfal sérülésére adott válasz lehet a folyamat kiváltó oka. Az első feltételezés szerint a vérben túl nagy mennyiségben keringő LDL különösebb nehézség nélkül bejut az érfalba, és a felhalmozódása indítja el az érelmeszesedést: A második álláspont úgy érvel, hogy az LDL azért kerül az adott területen az ér hámja alá, mert azt sérülés érte. Ezek szerint az ép hám nem engedné át az LDL-részecskéket, a plakk-képződés megindulásához a hámsejtek degradációja szükséges olyan tényezők által, mint például az érfalat feszülésre ingerlő dohányzás vagy magas vérnyomás, a sejteket támadó autoimmun folyamat, az erek falát köztudottan károsító magas vércukor vagy egyéb potenciálisan káros hatás. Tehát az LDL és az immunsejtek felszabadulása egy sérülésre adott válaszreakció, akár védekezési, reparációs mechanizmus lehet. A következő szakkönyv-fejezetben3 az írók a sejtek közötti tér, az extracelluláris mátrix anyagainak nagymértékű és szokatlan struktúrájú felszaporodásáról számolnak be az érfalban az érelmeszesedés nagyon korai fázisában, amely károsító anyagok jelenlétének tudható be. Ez a megváltozott extracelluláris mátrix, a normálistól eltérően, LDL-részecskéket vonz. Ugyanakkor ez, a ‘response-to-retention’ hipotézist hirdető cikk4 megállapítja, hogy az érelmeszesedés kialakulásához mindenképp magas LDL szint kell.
Ha a feltételezett mechanizmusokat összevetjük a korábban idézett tanulmányok eredményeivel, melyek szerint az LDL-szint nem korrelál egyértelműen a szívbetegség kockázatával, viszont a gyulladáscsökkentő omega 3 és 9 zsírsavakat tartalmazó mediterrán étrend csökkenti a halálozási statisztikákat, annak ellenére, hogy a koleszterinszintet nem: gyanítható, hogy az LDL-felvételhez és az atheroszklerotikus plakk kialakulásához fontos a sérülés és gyulladás, ami a ‘szívvédő’, gyulladáscsökkentő omega-zsírsavak fogyasztásával megelőzhető. Tény tehát, hogy az LDL kulcsszerepet játszik az érelmeszesedés mechanizmusában, de nem valószínű, hogy önmagában oka lehet annak. Pontos ismeretek híján az LDL-re fogni a szívbetegséget kicsit olyan, mintha az immunrendszerünket hibáztatnánk, hogy a kórokozók elleni harcban fájdalmas gyulladást generál egy gennyes sebben, vagy a sebészt, hogy a helytelen életmód okán fejlődött rák kiemelése során megvágja a beteget.
De tulajdonképpen milyen szerepet játszanak a lipidek, a koleszterin, a szív-és érrendszeri megbetegedésekben?
Az érelmeszesedés, idegen szóval atherosclerosis kialakulásában van kulcsszerepük. Az érelmeszesedés az artériák falának kóros elváltozása, megkeményedése és megvastadodása. Ekkor az artériák fala merevebbé válik, ami törékenyebbé teszi őket, az ér belső terének, lumenének beszűkülése pedig az elzáródás (pl. embólia esetén) kockázatát emeli.
Az érelmeszesedés mechanizmusa nagyjából ismert, a kiváltó okról viszont nincs egyértelmű tudományos egyetértés.
Az LDL funkciója, mint azt már korábban írtam, koleszterin és egyéb lipidek szállítása a keletkezés helyéről, azaz a májból a felhasználás helyére. Normál esetben az LDL részecskék szabályozott módon, az érfal hámsejtjein keresztül (ún. transzcitózissal) jutnak ki az érből. A koleszterin felhasználódik a környező sejtek által, a felesleges mennyiséget pedig a helyben létrejövő HDL juttatja vissza a májba, ami képes eltávolítani azt az epével.
Ha viszont az érfal integritása sérül, és/vagy2 túl sok LDL van a vérben, akkor a lipoproteinek a hámsejtek között átférkőzve, korlátlan mennyiségben tudnak az érfalba jutni. Itt a hámsejtek által kibocsátott anyagok hatására oxidálódnak, és az oxidált LDL-t a vérből kilépő falósejtek, makrofágok kebelezik be. A sok LDL-t felvett makrofágokat ‘habos sejteknek’ nevezzük, ezek elhalva adják a plakk fő tömegét, amely kalcium berakódásával az évek során szilárdul, meszesedik és nő, csökkentve az ér átmérőjét.
A nagy kérdés, hogy molekuláris szinten mi indítja el a plakk-képződést, nem tisztázott. Két fő hipotézis ismert: a ‘response-to-retention’ és a ‘response-to-injury’, azaz vagy az LDL-felvételre, vagy az érfal sérülésére adott válasz lehet a folyamat kiváltó oka. Az első feltételezés szerint a vérben túl nagy mennyiségben keringő LDL különösebb nehézség nélkül bejut az érfalba, és a felhalmozódása indítja el az érelmeszesedést: A második álláspont úgy érvel, hogy az LDL azért kerül az adott területen az ér hámja alá, mert azt sérülés érte. Ezek szerint az ép hám nem engedné át az LDL-részecskéket, a plakk-képződés megindulásához a hámsejtek degradációja szükséges olyan tényezők által, mint például az érfalat feszülésre ingerlő dohányzás vagy magas vérnyomás, a sejteket támadó autoimmun folyamat, az erek falát köztudottan károsító magas vércukor vagy egyéb potenciálisan káros hatás. Tehát az LDL és az immunsejtek felszabadulása egy sérülésre adott válaszreakció, akár védekezési, reparációs mechanizmus lehet. A következő szakkönyv-fejezetben3 az írók a sejtek közötti tér, az extracelluláris mátrix anyagainak nagymértékű és szokatlan struktúrájú felszaporodásáról számolnak be az érfalban az érelmeszesedés nagyon korai fázisában, amely károsító anyagok jelenlétének tudható be. Ez a megváltozott extracelluláris mátrix, a normálistól eltérően, LDL-részecskéket vonz. Ugyanakkor ez, a ‘response-to-retention’ hipotézist hirdető cikk4 megállapítja, hogy az érelmeszesedés kialakulásához mindenképp magas LDL szint kell.
Ha a feltételezett mechanizmusokat összevetjük a korábban idézett tanulmányok eredményeivel, melyek szerint az LDL-szint nem korrelál egyértelműen a szívbetegség kockázatával, viszont a gyulladáscsökkentő omega 3 és 9 zsírsavakat tartalmazó mediterrán étrend csökkenti a halálozási statisztikákat, annak ellenére, hogy a koleszterinszintet nem: gyanítható, hogy az LDL-felvételhez és az atheroszklerotikus plakk kialakulásához fontos a sérülés és gyulladás, ami a ‘szívvédő’, gyulladáscsökkentő omega-zsírsavak fogyasztásával megelőzhető. Tény tehát, hogy az LDL kulcsszerepet játszik az érelmeszesedés mechanizmusában, de nem valószínű, hogy önmagában oka lehet annak. Pontos ismeretek híján az LDL-re fogni a szívbetegséget kicsit olyan, mintha az immunrendszerünket hibáztatnánk, hogy a kórokozók elleni harcban fájdalmas gyulladást generál egy gennyes sebben, vagy a sebészt, hogy a helytelen életmód okán fejlődött rák kiemelése során megvágja a beteget.
 Ráadásul az LDL-nek vannak altípusai. Ilyen a ‘small dense’ (kicsi, nehéz) és a ‘large bouyant’ (nagyobb, könnyebb) LDL. Ezek megkülönböztetése, bár a vizsgálatokban még annyira nem elterjedt, nagyon fontos. Fontos, mert a kis méretű, small dense LDL, továbbiakban sdLD, sokkal fontosabb szerepet játszik az érelmeszesedésben, mint társai. Mivel kisebb és a sűrűsége nagyobb, könnyebben lép ki az érfalon, ha az nem zár megfelelően. Az étrend befolyásolja a keringő LDL részecskék méretét: a telített zsírok fogyasztása, úgy tűnik, hogy a kevésbé problémás nagy LDL-részecskék koncentrációját növeli5, viszont a nagy mennyiségű szénhidrát és a margarinok fogyasztása a kis sdLDL partikulumokét6 – a hivatkozott cikk szerint a vér trigliceridszintjének emelésén keresztül. A vér trigliceridszintje leginkább inzulin által növekszik, ez egy újabb jele annak, hogy a jelenleg érvényben lévő étrendi ajánlások nem töltik be megfelelően a rájuk ruházott szívvédő szerepet.
Membránok
A zsírszegény, főleg a telített zsírokban szegény diéta ajánlása szakmai körökben nem mindenhol váltott ki lelkesedést, sokakban inkább komoly aggodalmat. Minden sejtünket zsírmolekulákból álló membrán határolja és egyben köti össze a környezetével. A membránokban rengeteg ioncsatorna, recpetor található, és bekebelezési folyamatok mellett vegyületek szintézise és leadása is membránokhoz kötött. Az agy 70%-ban a neuronokat szigetelő zsírból áll. Az állati szervezet elsősorban telített zsírsavakat használ, az étrendi ajánlások viszont ezeket koleszterinnövelőnek bélyegezve a telítetlen zsírsavak fogyasztását javasolják. Olyan kutatók, mint a lipidszakértő E. H. Ahrens, aggodalmukat fejezték ki abban, hogy a telített zsírsavak és koleszterin bevitelének csökkentése megváltoztathatja a sejtmembránok struktúráját, áthatolhatóságát, integritását és a membránokhoz kapcsolt folyamatok működését. A koleszterin mindkét irányba képes befolyásolni a membránok folyékonyságát, így optimizálja azt. A telített zsírsavak inkább szilárdítják a membránt. A telítetlen zsírsavakban kettős kötés található, amely mentén töréspont alakul ki, a zsírsav elhajlik. Ezáltal több helyet foglal a térben, így lazítja és folyékonyabbá teszi a sejtmembránt. Ráadásul a kettős kötés könnyen roncsolódik, oxidálódik, ezért a telítetlen zsírsavak jobban ki vannak téve a káros hatásoknak. Bár a sejtek képesek a membránalkotó zsírsavak előállítására, ez sok energia, így a táplálékkal felvett zsírok felhasználása mindenképpen előnyös. Elképzelhető, hogy az elfogyasztott zsírok minőségi változása tükröződik a szervezet membránjain, ennek messzemenő következményei lehetnek.
Ráadásul az LDL-nek vannak altípusai. Ilyen a ‘small dense’ (kicsi, nehéz) és a ‘large bouyant’ (nagyobb, könnyebb) LDL. Ezek megkülönböztetése, bár a vizsgálatokban még annyira nem elterjedt, nagyon fontos. Fontos, mert a kis méretű, small dense LDL, továbbiakban sdLD, sokkal fontosabb szerepet játszik az érelmeszesedésben, mint társai. Mivel kisebb és a sűrűsége nagyobb, könnyebben lép ki az érfalon, ha az nem zár megfelelően. Az étrend befolyásolja a keringő LDL részecskék méretét: a telített zsírok fogyasztása, úgy tűnik, hogy a kevésbé problémás nagy LDL-részecskék koncentrációját növeli5, viszont a nagy mennyiségű szénhidrát és a margarinok fogyasztása a kis sdLDL partikulumokét6 – a hivatkozott cikk szerint a vér trigliceridszintjének emelésén keresztül. A vér trigliceridszintje leginkább inzulin által növekszik, ez egy újabb jele annak, hogy a jelenleg érvényben lévő étrendi ajánlások nem töltik be megfelelően a rájuk ruházott szívvédő szerepet.
Membránok
A zsírszegény, főleg a telített zsírokban szegény diéta ajánlása szakmai körökben nem mindenhol váltott ki lelkesedést, sokakban inkább komoly aggodalmat. Minden sejtünket zsírmolekulákból álló membrán határolja és egyben köti össze a környezetével. A membránokban rengeteg ioncsatorna, recpetor található, és bekebelezési folyamatok mellett vegyületek szintézise és leadása is membránokhoz kötött. Az agy 70%-ban a neuronokat szigetelő zsírból áll. Az állati szervezet elsősorban telített zsírsavakat használ, az étrendi ajánlások viszont ezeket koleszterinnövelőnek bélyegezve a telítetlen zsírsavak fogyasztását javasolják. Olyan kutatók, mint a lipidszakértő E. H. Ahrens, aggodalmukat fejezték ki abban, hogy a telített zsírsavak és koleszterin bevitelének csökkentése megváltoztathatja a sejtmembránok struktúráját, áthatolhatóságát, integritását és a membránokhoz kapcsolt folyamatok működését. A koleszterin mindkét irányba képes befolyásolni a membránok folyékonyságát, így optimizálja azt. A telített zsírsavak inkább szilárdítják a membránt. A telítetlen zsírsavakban kettős kötés található, amely mentén töréspont alakul ki, a zsírsav elhajlik. Ezáltal több helyet foglal a térben, így lazítja és folyékonyabbá teszi a sejtmembránt. Ráadásul a kettős kötés könnyen roncsolódik, oxidálódik, ezért a telítetlen zsírsavak jobban ki vannak téve a káros hatásoknak. Bár a sejtek képesek a membránalkotó zsírsavak előállítására, ez sok energia, így a táplálékkal felvett zsírok felhasználása mindenképpen előnyös. Elképzelhető, hogy az elfogyasztott zsírok minőségi változása tükröződik a szervezet membránjain, ennek messzemenő következményei lehetnek.
 A végére ez az ábra lehet érdekes Gary Taubes cikkéből, amely pusztán összefüggéseket mutat. Ez alapján nőknél csak az alacsony, férfiaknál mind a túl alacsony, mind a túl magas koleszterin kockázati tényező. Az ábrából az általános életmódtényezők nem megismerhetők, de a koleszterincsökkentés túlzásba vitele nem tűnik jó ötletnek az adatai alapján.
Ez a cikk tulajdonképpen csak a felszínt kapargatja, az emberi test működése önmagában is elképesztően bonyolult, hát még, ha belevesszük az egyenletbe a különböző táplálkozási protokollokat. A megfelelő táplálkozással kapcsolatban ökölszabály, hogy érdemes az ételeket a lehető legtermészetesebb formában bevinni. A három és fél százalékos zsírtartalmú, tejen kívül csak baktériumokat tartalmazó görög joghurt biztosan jobb, mint a másfél, fél, vagy 0,1 százalékos, cukrozott, ízfokozót tartalmazó low fat termék, és a jó tartásból származó szalonna is jobb opció a védőgázból frissen kicsomagolt light sonkánál. Összességében viszont a természetesség nem elegendő válasz, ha az ember olyan intő tüneteket tapasztal, mint a hullámzó energiaszint a nap során, a sok álmosság, a kajakóma vagy az evés után néhány órával bekövetkező ‘crash’. A szervezet rengeteg különböző hormonnal és szöveti faktorral, idegi mechanizmussal és emésztőenzimmel végzi a táplálék feldolgozását, felvételét, raktározását és szortírozását. A nagyszámú mechanizmus elképesztően bonyolult rendszere mozgásteret ad az egyéni különbségeknek és eltérő igényeknek; a test pedig azzal az üzemanyaggal működik legjobban, amely feldolgozásához megfelel a genetikája. Van, aki igényli a szénhidrátot, van, aki magas zsír-, de alacsony szénhidráttartalmú étrend mellett a legkiegyensúlyozottabb. Az egyéni anyagcseretípus megismerhető sok kísérletezéssel, és az Akadémia szolgáltatásai között szereplő Táplálkozási Profil kérdőívének szakemberrel történő kielemzése is segítséget – és sok jó tanácsot – nyújthat. A zsírok családjának többi tagjáról pedig hamarosan további cikkeket olvashattok tőlem a blogon.
A végére ez az ábra lehet érdekes Gary Taubes cikkéből, amely pusztán összefüggéseket mutat. Ez alapján nőknél csak az alacsony, férfiaknál mind a túl alacsony, mind a túl magas koleszterin kockázati tényező. Az ábrából az általános életmódtényezők nem megismerhetők, de a koleszterincsökkentés túlzásba vitele nem tűnik jó ötletnek az adatai alapján.
Ez a cikk tulajdonképpen csak a felszínt kapargatja, az emberi test működése önmagában is elképesztően bonyolult, hát még, ha belevesszük az egyenletbe a különböző táplálkozási protokollokat. A megfelelő táplálkozással kapcsolatban ökölszabály, hogy érdemes az ételeket a lehető legtermészetesebb formában bevinni. A három és fél százalékos zsírtartalmú, tejen kívül csak baktériumokat tartalmazó görög joghurt biztosan jobb, mint a másfél, fél, vagy 0,1 százalékos, cukrozott, ízfokozót tartalmazó low fat termék, és a jó tartásból származó szalonna is jobb opció a védőgázból frissen kicsomagolt light sonkánál. Összességében viszont a természetesség nem elegendő válasz, ha az ember olyan intő tüneteket tapasztal, mint a hullámzó energiaszint a nap során, a sok álmosság, a kajakóma vagy az evés után néhány órával bekövetkező ‘crash’. A szervezet rengeteg különböző hormonnal és szöveti faktorral, idegi mechanizmussal és emésztőenzimmel végzi a táplálék feldolgozását, felvételét, raktározását és szortírozását. A nagyszámú mechanizmus elképesztően bonyolult rendszere mozgásteret ad az egyéni különbségeknek és eltérő igényeknek; a test pedig azzal az üzemanyaggal működik legjobban, amely feldolgozásához megfelel a genetikája. Van, aki igényli a szénhidrátot, van, aki magas zsír-, de alacsony szénhidráttartalmú étrend mellett a legkiegyensúlyozottabb. Az egyéni anyagcseretípus megismerhető sok kísérletezéssel, és az Akadémia szolgáltatásai között szereplő Táplálkozási Profil kérdőívének szakemberrel történő kielemzése is segítséget – és sok jó tanácsot – nyújthat. A zsírok családjának többi tagjáról pedig hamarosan további cikkeket olvashattok tőlem a blogon.
Miksa Henkrich
Az Akadémia Ifjúsági egészségbloggere, biológia hallgató
1 zsírsavszintézis – acetil-KoA-karboxiláz, TG szintézis – glicerin-3-foszfát-aciltranszferáz
2 hogy és vagy vagy, alapvető és nem egyértelmű kérdés, amint később látható
3 https://www.ncbi.nlm.nih.gov/books/NBK2029/
4 https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2924812/
5 https://academic.oup.com/cdn/article/3/Supplement_1/nzz044.P08-128-19/5606468; https://pubmed.ncbi.nlm.nih.gov/21816443/; https://pubmed.ncbi.nlm.nih.gov/15485591/
6 https://pubmed.ncbi.nlm.nih.gov/16256003/
Mennyire tetszett? / How much did you like it?
Klikk a csillagra / Click a star

